I gas, dal punto di vista della termodinamica, sono descritti da un insieme di caratteristiche macroscopiche, le principali delle quali sono temperatura, pressione e volume. La costanza di uno di questi parametri e la variazione degli altri due indica che nel gas si verifica l'uno o l' altro isoprocesso. Dedicheremo questo articolo a una risposta dettagliata alle domande che questo è un processo isocoro, come differisce dai cambiamenti isotermici e isobarici negli stati di un sistema a gas.
Gas ideale in fisica

Prima di rispondere alla domanda che si tratta di un processo isocoro, dovresti conoscere meglio il concetto di gas ideale. In fisica, è inteso come qualsiasi gas in cui l'energia cinetica media delle sue particelle costituenti supera di gran lunga l'energia potenziale della loro interazione e le distanze tra queste particelle sono diversi ordini di grandezza maggiori delle loro dimensioni lineari. Nelle condizioni annotate, è possibile, durante l'esecuzionei calcoli non tengono conto dell'energia di interazione tra le particelle (è uguale a zero), e si può anche presumere che le particelle siano punti materiali aventi una certa massa m.
L'unico processo che avviene in un gas ideale è la collisione delle particelle con le pareti del recipiente contenente la sostanza. Queste collisioni si manifestano in pratica come l'esistenza di una certa pressione nel gas P.
Di norma, qualsiasi sostanza gassosa costituita da molecole chimicamente inerti e con bassa pressione e alte temperature può essere considerata un gas ideale con sufficiente accuratezza per calcoli pratici.
Equazione che descrive un gas ideale
Certo, stiamo parlando della legge universale di Clapeyron-Mendeleev, che dovrebbe essere ben compresa per capire che questo è un processo isocoro. Quindi, l'equazione di stato universale ha la seguente forma:
PV=nRT.
Ovvero, il prodotto della pressione P e del volume del gas V è uguale al prodotto della temperatura assoluta T e della quantità di sostanza in moli n, dove R è il fattore di proporzionalità. L'equazione stessa fu scritta per la prima volta da Emile Clapeyron nel 1834 e negli anni '70 del XIX secolo D. Mendeleev vi sostituì un insieme di valori costanti di una singola costante gassosa universale R (8,314 J/(molK)).
Secondo l'equazione di Clapeyron-Mendeleev, in un sistema chiuso il numero di particelle di gas rimane costante, quindi ci sono solo tre parametri macroscopici che possono cambiare (T, Pe V). Quest'ultimo fatto è alla base della comprensione dei vari isoprocessi che verranno discussi di seguito.
Cos'è un processo isocoro?
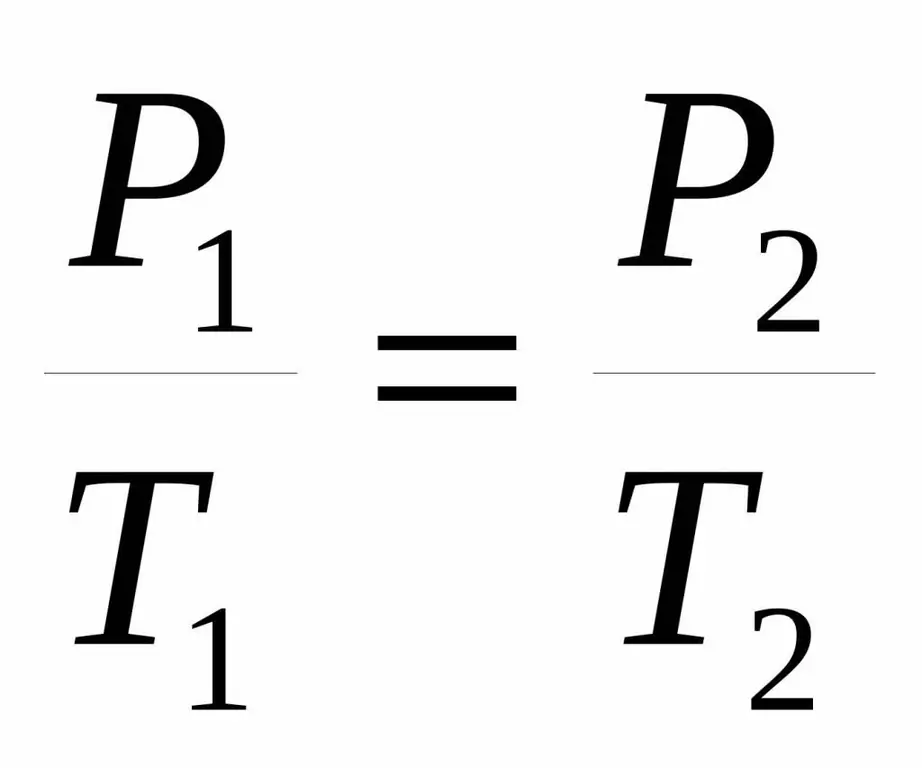
Questo processo è inteso come qualsiasi cambiamento nello stato del sistema, in cui il suo volume è preservato.
Se passiamo all'equazione di stato universale, possiamo dire che in un processo isocoro solo la pressione e la temperatura assoluta cambiano in un gas. Per capire esattamente come cambiano i parametri termodinamici, scriviamo la corrispondente espressione matematica:
P / T=cost.
A volte questa uguaglianza è data in una forma leggermente diversa:
P1 / T1=RE2 / T 2.
Entrambe le uguaglianze sono dette legge di Carlo dal nome di uno scienziato francese che alla fine del 18° secolo ottenne sperimentalmente la nota dipendenza.

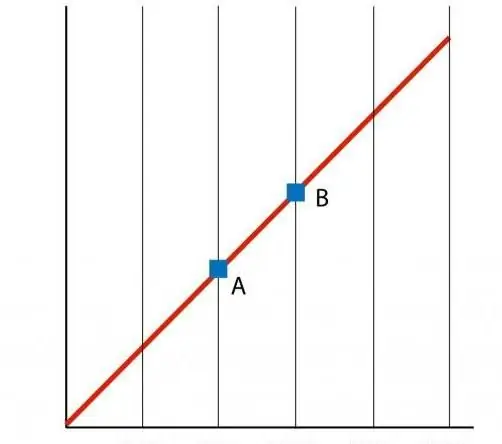
Se costruiamo un grafico della funzione P(T), otteniamo una dipendenza lineare, che viene chiamata isocore. Qualsiasi isocore (per tutti i valori di n e V) è una linea retta.
Descrizione energetica del processo
Come notato, un processo isocoro è un cambiamento nello stato di un sistema che avviene in un sistema chiuso ma non isolato. Si tratta della possibilità di scambio termico tra il gas e l'ambiente. In generale, qualsiasi fornitura di calore Q al sistema porta a due risultati:
- cambia l'energia interna U;
- gasfunziona A, in espansione o in contrazione.
L'ultima inferenza è scritta matematicamente come segue:
Q=LA + LA.
Il processo isocoro di un gas ideale, per sua definizione, non implica il lavoro svolto dal gas, poiché il suo volume rimane invariato. Ciò significa che tutto il calore fornito all'impianto va ad aumentare la sua energia interna:
Q=U.
Se sostituiamo la formula esplicita per l'energia interna in questa espressione, allora il calore del processo isocoro può essere rappresentato come:
Q=z / 2nRT.
Qui z è il numero di gradi di libertà, che è determinato dalla natura poliatomica delle molecole che compongono il gas. Per un gas monoatomico, z=3, per un gas biatomico - 5, e per un triatomico e altro - 6. Qui, sotto i gradi di libertà, si intendono i gradi traslazionali e rotazionali.
Se confrontiamo l'efficienza del riscaldamento di un sistema a gas nei processi isocorici e isobarici, nel primo caso otterremo la massima efficienza, poiché durante il cambiamento isobarico nello stato del sistema, il gas si espande e parte dell'apporto di calore viene speso per il lavoro.
Processo isobarico
Sopra abbiamo descritto in dettaglio che questo è un processo isocoro. Ora diciamo qualche parola su altri isoprocessi. Cominciamo con isobarico. In base al nome, è inteso come il passaggio del sistema tra stati a pressione costante. Questo processo è descritto dalla legge Gay-Lussac come segue:
V / T=cost.
Come per l'isocore, anche l'isobara V(T) rappresenta una linea retta sul grafico.
Perdi qualsiasi processo isobarico, è conveniente calcolare il lavoro svolto dal gas, poiché è uguale al prodotto della pressione costante per la variazione di volume.
Processo isotermico
Questo è un processo in cui la temperatura del sistema rimane costante. È descritto dalla legge di Boyle-Mariotte per un gas ideale. È curioso notare che questa è la prima legge sui gas scoperta sperimentalmente (seconda metà del XVII secolo). La sua notazione matematica è simile a questa:
PV=cost.
I processi isocorici e isotermici differiscono in termini di rappresentazione grafica, poiché la funzione P(V) è una relazione iperbolica, non lineare.
Esempio di risoluzione dei problemi
Consolidiamo le informazioni teoriche fornite nell'articolo dalla loro applicazione per risolvere un problema pratico. È noto che l'azoto gassoso puro era in un cilindro alla pressione di 1 atmosfera e alla temperatura di 25 °C. Dopo che la bombola del gas è stata riscaldata e la pressione al suo interno è stata misurata, si è rivelato essere 1,5 atmosfere. Qual è la temperatura del gas nel cilindro dopo il riscaldamento? Di quale importo è cambiata l'energia interna del gas se c'erano 4 moli di azoto nel pallone.
Per rispondere alla prima domanda, usiamo la seguente espressione:
P1 / T1=RE2 / T 2.
Da dove otteniamo:
T2=RE2 / RE1 T 1.
In questa espressione, la pressione può essere sostituita in unità arbitrariemisurazioni, poiché si stanno riducendo e la temperatura è solo in kelvin. Detto questo, otteniamo:
T2=1.5 /1298.15=447.224 K.
La temperatura calcolata in gradi Celsius è 174 °C.
Poiché la molecola di azoto è biatomica, la variazione della sua energia interna durante il riscaldamento può essere determinata come segue:
ΔU=5 / 2nRΔT.
Sostituendo i valori noti in questa espressione, otterremo la risposta alla seconda domanda del problema: ΔU=+12,4 kJ.






