Il metodo di analisi conduttometrico è la misurazione della conducibilità elettrolitica per monitorare l'andamento di una reazione chimica. Questa scienza è ampiamente applicata nella chimica analitica, dove la titolazione è un metodo operativo standard. Che cos'è la conduttometria? Nella pratica comune in chimica analitica, il termine è usato come sinonimo di titolazione, mentre è anche usato per descrivere applicazioni non di titolazione. Qual è il vantaggio di utilizzare questo metodo di analisi? Viene spesso utilizzato per determinare la conduttività complessiva di una soluzione o per analizzare il punto finale di una titolazione che coinvolge gli ioni.
Cronologia
Le misurazioni conduttive iniziarono già nel 18° secolo, quando Andreas Baumgartner notò che le acque saline e minerali di Bad Gastein inL'Austria conduce l'elettricità. Pertanto, l'uso di questo metodo per determinare la purezza dell'acqua, che viene spesso utilizzato oggi per testare l'efficacia dei sistemi di purificazione dell'acqua, iniziò nel 1776. Iniziò così la storia del metodo di analisi conduttometrico.
Friedrich Kohlrausch continuò lo sviluppo di questa scienza negli anni '60 dell'Ottocento, quando applicò la corrente alternata all'acqua, agli acidi e ad altre soluzioni. In questo periodo, Willis Whitney, che stava studiando le interazioni dei complessi di acido solforico e solfato di cromo, trovò il primo endpoint conduttometrico. Questi risultati culminarono nella titolazione potenziometrica e nel primo strumento per l'analisi volumetrica di Robert Behrend nel 1883 nella titolazione di cloruro e bromuro HgNO3. Pertanto, il moderno metodo di analisi conduttometrico si basa su Behrend.
Questo sviluppo ha permesso di testare la solubilità dei sali e la concentrazione di ioni idrogeno, nonché le titolazioni acido-base e redox. Il metodo di analisi conduttometrico è stato migliorato con lo sviluppo dell'elettrodo di vetro, iniziato nel 1909.
Titolazione
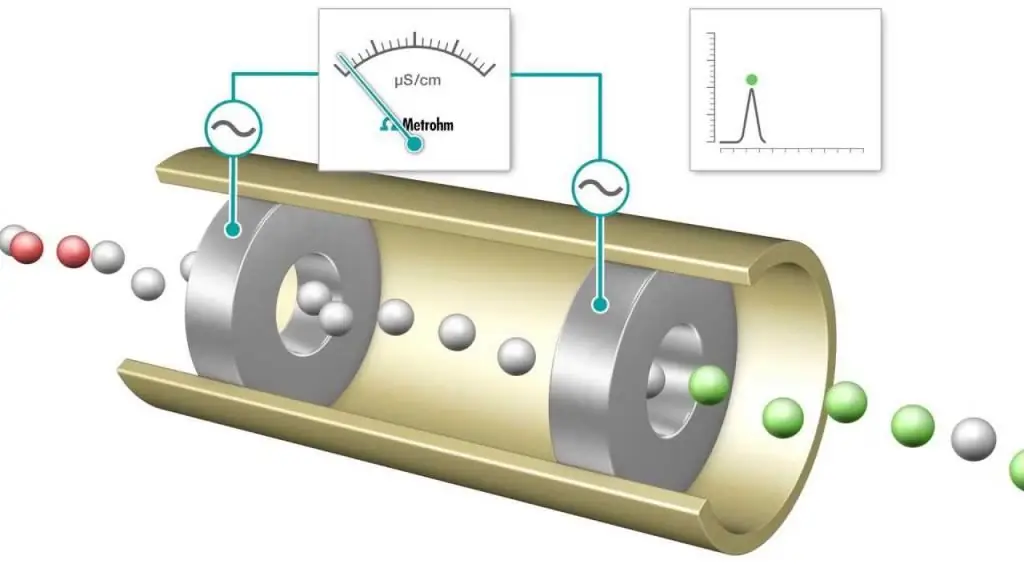
La titolazione conduttometrica è una misura in cui la conduttività elettrolitica di una miscela di reazione viene continuamente monitorata aggiungendo un reagente. Il punto di equivalenza è il punto in cui la conducibilità cambia improvvisamente. Un notevole aumento o diminuzione della conduttività è associato a un cambiamento nella concentrazione dei due ioni più altamente conduttivi, idrogeno e ioni idrossido. Questo metodopuò essere utilizzato per titolare soluzioni colorate o sospensioni omogenee (es. sospensione di pasta di legno) che non possono essere utilizzate con gli indicatori convenzionali.
Vengono spesso eseguite titolazioni acido-base e redox, che utilizzano indicatori comuni per determinare il punto finale, come metilarancio, fenolftaleina per la titolazione acido-base e soluzioni di amido per un processo redox di tipo iodometrico. Tuttavia, le misurazioni della conducibilità elettrica possono essere utilizzate anche come strumento per determinare il punto finale, ad esempio osservando una soluzione di HCl con la base forte NaOH.
Neutralizzazione dei protoni
Man mano che la titolazione procede, i protoni vengono neutralizzati per formare NaOH formando acqua. Per ogni quantità di NaOH aggiunta, viene rimosso un numero equivalente di ioni idrogeno. In effetti, il catione H+ mobile viene sostituito dallo ione Na+ meno mobile e la conduttività della soluzione titolata, così come la conducibilità cellulare misurata, diminuiscono. Questo continua fino a raggiungere un punto di equivalenza in cui si può ottenere una soluzione di cloruro di sodio NaCl. Se viene aggiunta più base, c'è un aumento man mano che vengono aggiunti più ioni Na+ e OH- e la reazione di neutralizzazione non rimuove più una quantità apprezzabile di H+.

Di conseguenza, quando un acido forte viene titolato con una base forte, la conducibilità ha un minimo al punto di equivalenza. Questo minimopuò essere utilizzato al posto di un colorante indicatore per determinare il punto finale di una titolazione. La curva di titolazione è un grafico dei valori misurati di conducibilità o conducibilità in funzione del volume della soluzione di NaOH aggiunta. La curva di titolazione può essere utilizzata per determinare graficamente il punto di equivalenza. Il metodo di analisi conduttometrico (e il suo utilizzo) è estremamente rilevante nella chimica moderna.
Reazione
Per una reazione tra una base debole e acido debole, la conduttività elettrica prima diminuisce leggermente, poiché vengono utilizzati pochi ioni H+ disponibili. Quindi la conducibilità aumenta leggermente fino al volume del punto di equivalenza per il contributo del catione sale e dell'anione (questo contributo nel caso di una base acida forte è trascurabile e non viene considerato lì). Dopo il punto di equivalenza è raggiunto, la conducibilità aumenta rapidamente a causa di un eccesso di ioni OH.
I rivelatori di conducibilità (metodo di analisi conduttometrico) vengono utilizzati anche per misurare le concentrazioni di elettroliti in soluzioni acquose. La concentrazione molare dell'analita che crea la conduttività della soluzione può essere ottenuta dalla resistenza elettrica misurata della soluzione.
Metodo di analisi conduttometrico: principio e formule
(2.4.13) C=Constcell1Λm1Res, dove Constcell è un valore costante dipendente dalla cella di misura, Res è la resistenza elettrica misurata dal dispositivo (secondo la legge di Ohm Res=I / V, e con una costante tensione V misura I intensità permette di calcolare Res), e Λm è l'equivalenteconducibilità per particelle ioniche. Sebbene ai fini pratici Λm possa essere considerato costante, dipende dalla concentrazione secondo la legge di Kohlrausch:
(2.4.14)=Хт Λm0-ΘC, dove Θ è una costante e Λm0 è la conducibilità molare limite caratteristica di ciascuno ione. La conducibilità molare, a sua volta, dipende dalla temperatura.
Scrit
Lo sviluppo del metodo conduttometrico di analisi delle misurazioni ha portato gli scienziati a nuove scoperte. Gli scienziati hanno determinato il rapporto critico di supersaturazione, Scrit, utilizzando la conduttimetria in un sistema di precipitazione AgCl omogeneo in eccesso rispetto agli ioni Ag+, utilizzando l'idrolisi del cloruro di alchile come fonte di ioni CI". Hanno trovato Scrit=1,51, 1,73 e 1,85 rispettivamente a 15, 25 e 35°C, dove S=([Ag+][Cl-] / Ksp) 1/2 secondo la loro definizione. Se questa definizione del fattore di sovrasaturazione viene convertita nella nostra (S=[Ag+][Cl-] / Ksp), i risultati sono rispettivamente 2,28, 2,99 e 3,42, in discreto accordo con i risultati del presente studio. Tuttavia, la dipendenza dalla temperatura di Scrit è opposta a quella descritta nel presente studio. Sebbene la ragione di questa contraddizione non sia chiara, la diminuzione di Scrit all'aumentare della temperatura può essere abbastanza ragionevole, poiché la velocità di nucleazione cambia drasticamente con una piccola variazione di ΔGm/ kT, e quindi ΔGm/ kT, che è proporzionale a T − 3 (lnSm) 2 secondo la formula (1.4.12) è considerato quasi costante al variare della temperatura nel sistema dato. Per inciso, la definizione di S deve essere [Ag +] [Cl -] / Ksp, poiché il rapporto di sovrasaturazione in termini diLa concentrazione del monomero [AgCl] è inizialmente indicata come S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp.
Tanaka e Iwasaki
La storia del metodo di analisi conduttometrico è stata continuata da due iconici scienziati giapponesi. Tanaka e Iwasaki hanno studiato il processo di nucleazione delle particelle AgCl e AgBr utilizzando il metodo del flusso interrotto in combinazione con uno spettrofotometro multicanale, utile per studiare un processo veloce dell'ordine di msec. Hanno scoperto che uno specifico complesso di alogenuri d'argento AgXm (m-1), avente una banda di assorbimento UV piuttosto stretta, si è formato istantaneamente quando una soluzione di AgC104 dell'ordine di 10-4 mol dm-3 è stata miscelata con un KX (X=Cl o Br) soluzione dell'ordine da 10-2 a 10-1 mol dm-3 seguita dal suo rapido decadimento di circa 10 ms con formazione di un prodotto intermedio avente un ampio assorbimento UV e una variazione molto più lenta dello spettro del prodotto intermedio. Hanno interpretato l'intermedio come nuclei monodispersi (AgX) n costituiti da n molecole e determinato n dal rapporto apparente -dC/dt α Cn a t=0 per varie concentrazioni iniziali del precursore C AgXm (m-1) - (n=7 -10 per AgCl, n=3-4 per AgBr).

Tuttavia, poiché il precursore AgXm (m − 1) decade in modo non stazionario, la teoria della nucleazione quasi-stazionaria non si applica a questo processo, e quindi il valore risultante di n non corrisponde al nvalore dei nuclei critici. Se il prodotto intermedio contiene nuclei monodispersi n,formato dal complesso monomerico, il rapporto -dC/dt αC potrebbe non essere mantenuto. A meno che non si assuma che gruppi più piccoli di n-meri siano in equilibrio, ki − 1, ici − 1c1=ki, i − 1ci, tra loro in una reazione sequenziale c1 → c2 → c3 →… → cn − 1 → cn., e solo l'ultimo passaggio cn − 1 → cn è irreversibile; cioè c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
Inoltre, si dovrebbe presumere che le concentrazioni dei cluster da 2 a n-1 abbiano concentrazioni di equilibrio trascurabili. Tuttavia, non sembra esserci alcuna base per giustificare queste ipotesi. D' altra parte, abbiamo cercato di calcolare i raggi dei nuclei critici e i coefficienti di sovrasaturazione S al termine del processo veloce, utilizzando γ=101 mJ m − 2 per AgCl19 cubico e γ=109 mJ m − 2 per AgBr20 cubico, supponendo che i valori di n, 7-10 per AgCl19 e 3-4 per AgBr20, siano equivalenti alla dimensione dei nuclei monodispersi, n. Il metodo di analisi conduttometrico, le cui revisioni vanno dalla semplice approvazione all'ammirazione, ha dato una nuova nascita alla chimica come scienza.
Di conseguenza, gli scienziati hanno scoperto la seguente formula: r=0,451 nm e S=105 per AgCl con n=9; r=0,358 nm e S=1230 per AgBr con n=4. Poiché i loro sistemi sono paragonabili a quelli di Davis e Jones, che hanno ottenuto una sovrasaturazione critica di AgCl di circa 1,7-2,0 a 25 °C. Utilizzando la conduttometria a miscela diretta in volumi uguali di soluzioni acquose diluite di AgNO3 e KCl, valori di S estremamente elevati potrebbero non riflettere i fattori di sovrasaturazione effettivi.in equilibrio con nuclei intermedi.
Assorbimento UV
Sembra più ragionevole attribuire un intermedio con ampio assorbimento UV a nuclei molto più grandi della media con un'ampia distribuzione dimensionale generata da una reazione sequenziale non stazionaria. Il successivo lento cambiamento dei nuclei intermedi sembra essere correlato alla loro maturazione ad Ostwald.

Nel contesto sopra, anche il chimico americano Nielsen ha derivato un nsimile intorno a 12 e un corrispondente S maggiore di 103 per la nucleazione di particelle di solfato di bario da misure di torbidità in funzione della sovrasaturazione, utilizzando n=dlogJ / dlogC in una teoria di tipo Becher-Dering alla formula. (1.3.37), ma dando (n+ 1) invece di n. Poiché in questo esperimento sono state miscelate direttamente soluzioni di ioni bario e ioni solfato, la nucleazione transitoria veloce dovrebbe essere terminata immediatamente dopo la miscelazione e ciò che è stato misurato potrebbe essere il tasso di lenta successiva maturazione di Ostwald e/o fusione dei nuclei generati. Apparentemente, questa è la ragione del valore irragionevolmente piccolo di n e della sovrasaturazione estremamente elevata. Pertanto, dobbiamo ancora notare che per ottenere una nucleazione quasi stazionaria in un sistema chiuso è sempre necessario un serbatoio di specie monomeriche che le rilascia in risposta al loro consumo. Tutte le teorie classiche della nucleazione, inclusa la teoria di Becher-Döring, presuppongono implicitamente una tale condizione. Definizione di conduttometricoil metodo di analisi è stato fornito nelle sezioni dell'articolo precedente.
Altri scienziati hanno studiato il processo di nucleazione transitoria dell'alogenuro d'argento mediante radiolisi pulsata di acqua contenente alogenuro di metilene e ioni d'argento, durante il quale l'alogenuro di metilene viene decomposto per rilasciare ioni alogenuro da elettroni idratati generati da radiazioni pulsate nell'intervallo da 4 ns a 3 μs. Gli spettri dei prodotti sono stati registrati utilizzando un fotomoltiplicatore e una streak camera e si è scoperto che i precursori degli alogenuri d'argento monomerici si formavano in un tempo dell'ordine dei microsecondi seguito da un processo di nucleazione simile a quello osservato da Tanaka e Iwasaki. I loro risultati mostrano chiaramente che il processo di nucleazione degli alogenuri d'argento per miscelazione diretta dei reagenti consiste in due fasi elementari; cioè la formazione di un precursore monomerico dell'ordine di μs e la successiva transizione a nuclei dell'ordine di 10 ms. Va notato che la dimensione media dei nuclei è di circa 10 nm.
Saturazione
Per quanto riguarda i coefficienti di supersaturazione per la nucleazione di particelle di AgCl in sistemi aperti in cui alte concentrazioni di reagenti come AgNO3 e KCl vengono introdotte continuamente nella soluzione di gelatina durante la precipitazione, Strong e Wey31 hanno riportato 1.029 (80° C) - 1.260 (40°C) e Leubner32 hanno riportato 1.024 a 60°C come stimato dalla misurazione del tasso di crescita delle particelle di semi di AgCl a sovrasaturazione critica. Questa è l'essenza del metodo conduttometrico dell'analisi quantitativa.
D' altra parte, per i sistemi di particelle AgBr aperti, alcunivalori stimati del coefficiente di sovrasaturazione critico, Scrit: Scrit∼- 1,5 a 70 °C secondo Wey e Strong33 dal tasso di crescita massimo dipendente dalle dimensioni determinato trovando la soglia di rinucleazione a diverse velocità di aggiunta di una soluzione di AgNO3 a un KBr soluzione in presenza di particelle di seme dai doppi getti; Scrit=1,2-1,5 a 25°C secondo Jagannathan e Wey34 come fattore di supersaturazione massimo determinato dall'equazione di Gibbs-Thomson con i loro dati sulla dimensione media minima dei nuclei osservata al microscopio elettronico durante la fase di nucleazione della precipitazione AgBr a due getti. Questo è molto efficace quando si applica il metodo di quantificazione conduttometrica.

Nel calcolare questi valori Scrit, hanno preso γ=140 mJ m − 2. Poiché la nucleazione in sistemi aperti corrisponde al processo di sopravvivenza dei nuclei nascenti creati in una zona locale di supersaturazione estremamente elevata vicino agli sbocchi del reagente, critico la sovrasaturazione corrisponde alla concentrazione del soluto in equilibrio con nuclei di dimensione massima, se utilizziamo i dati di Sugimoto35 sul raggio massimo dei nuclei di AgBr in sistemi aperti (.3 8.3 nm) con γ teorico per AgBr cubico (=109 mJ m − 2) 3, quindi il fattore di sovrasaturazione critico, Scrit, viene calcolato come sarebbe 1,36 a 25°C (se si assume che γ sia 140 mJ/m2, allora Scrit=1,48).
Conseguente, comunque, sovrasaturazioni critiche ini sistemi aperti di particelle di alogenuro d'argento sono in genere ben al di sotto delle sovrasaturazioni massime (probabilmente vicine alle sovrasaturazioni critiche) nei sistemi chiusi. Questo perché il raggio medio dei nuclei generati nella zona locale di un sistema aperto è molto più grande di rmin un sistema chiuso, probabilmente a causa della fusione istantanea di nuclei primari altamente concentrati nella zona locale di un sistema aperto con un alto concentrazione locale di elettroliti.
Applicazione
L'uso del metodo di titolazione conduttometrica per la registrazione continua durante i processi enzimatici è stato ampiamente studiato e analizzato. Quasi tutti i metodi analitici elettrochimici si basano su reazioni elettrochimiche (potenziometria, voltammetria, amperometria, coulometria).
Il metodo di analisi conduttometrico è un metodo in cui o non ci sono reazioni elettrochimiche sugli elettrodi, o ci sono reazioni secondarie che possono essere trascurate. Pertanto, in questo metodo, la proprietà più importante della soluzione elettrolitica nello strato limite è la sua conduttività elettrica, che varia in base a una gamma abbastanza ampia di reazioni biologiche.
Vantaggi
I biosensori conduttometrici presentano anche alcuni vantaggi rispetto ad altri tipi di trasduttori. In primo luogo, possono essere realizzati utilizzando la tecnologia standard a film sottile a basso costo. Questo, insieme all'uso di un metodo ottimizzato per l'immobilizzazione del materiale biologico, porta a una significativa riduzione sia del costo primario dei dispositivi checosto totale dell'analisi Per i microbiosensori integrati, è facile eseguire la modalità di misurazione differenziale, che compensa le influenze esterne e migliora notevolmente l'accuratezza della misurazione.
I dati mostrano chiaramente il grande potenziale dei biosensori conduttometrici. Tuttavia, questa è ancora una tendenza abbastanza nuova nei biosensori, quindi lo sviluppo di dispositivi commerciali ha un futuro promettente.
Nuovi metodi
Alcuni scienziati hanno descritto un metodo generale per misurare il pKa mediante conduttanza. Questo metodo è stato ampiamente utilizzato fino al 1932 circa (prima che fossero utilizzati metodi di misurazione del pH). Il metodo conduttometrico è estremamente sensibile alla temperatura e non può essere utilizzato per misurare valori di pKa sovrapposti. Un possibile vantaggio per i campioni senza un cromoforo è che può essere utilizzato in soluzioni molto diluite, fino a 2,8 × 10-5 M. Negli ultimi anni, la conduttimetria 87 è stata utilizzata per misurare il pKa della lidocaina, sebbene il risultato ottenuto fosse 0,7 per unità al di sotto del valore pH generalmente accettato.

Albert e Sergeant hanno anche descritto un metodo per determinare il pKa dalle misurazioni della solubilità. Come accennato in precedenza, la solubilità dipende dal pKa, quindi se la solubilità viene misurata a più valori di pH su una curva, è possibile determinare il pKa. Peck e Benet hanno descritto un metodo generale per stimare i valori di pKa per sostanze monoprotiche, diprotiche e anfotere data una serie di misurazioni di solubilità e pH. Hansen e Hafliger hanno ottenuto il pKa del campione, chesi decompone rapidamente per idrolisi dalla sua velocità di dissoluzione iniziale in funzione del pH in un dispositivo a disco rotante. Il risultato concorda bene con il risultato pH/UV, ma la decomposizione rende difficile quest'ultimo metodo. Questa è, in generale, una descrizione del metodo di analisi conduttometrico.






