La termodinamica è una branca importante della fisica. Possiamo tranquillamente affermare che i suoi risultati hanno portato all'emergere dell'era tecnologica e hanno ampiamente determinato il corso della storia umana negli ultimi 300 anni. L'articolo discute il primo, il secondo e il terzo principio della termodinamica e la loro applicazione nella pratica.
Cos'è la termodinamica?
Prima di formulare le leggi della termodinamica, scopriamo cosa fa questa sezione di fisica.
La parola "termodinamica" è di origine greca e significa "movimento dovuto al calore". Cioè, questa branca della fisica è impegnata nello studio di qualsiasi processo, a seguito del quale l'energia termica viene convertita in movimento meccanico e viceversa.
Le leggi fondamentali della termodinamica furono formulate a metà del 19° secolo. La scienza del "movimento e del calore" considera il comportamento dell'intero sistema nel suo insieme, studiando il cambiamento dei suoi parametri macroscopici: temperatura, pressione e volume e non prestando attenzione alla sua struttura microscopica. Inoltre, il primo di essi svolge un ruolo fondamentale nella formulazione delle leggitermodinamica in fisica. È curioso notare che derivano esclusivamente da osservazioni sperimentali.
Il concetto di sistema termodinamico

Significa qualsiasi gruppo di atomi, molecole o altri elementi considerati come un tutto. Tutte e tre le leggi sono formulate per il cosiddetto sistema termodinamico. Esempi sono: l'atmosfera terrestre, qualsiasi organismo vivente, la miscela di gas in un motore a combustione interna, ecc.
Tutti i sistemi in termodinamica appartengono a uno di tre tipi:
- Aperto. Scambiano calore e materia con l'ambiente. Ad esempio, se il cibo viene cotto in una pentola a fuoco aperto, questo è un vivido esempio di sistema aperto, poiché la pentola riceve energia dall'ambiente esterno (fuoco), mentre essa stessa irradia energia sotto forma di calore, e anche l'acqua evapora da esso (metabolismo).
- Chiuso. In tali sistemi non c'è scambio di materia con l'ambiente, sebbene avvenga lo scambio di energia. Tornando al caso precedente: se copri il bollitore con un coperchio, puoi ottenere un sistema chiuso.
- Isolato. Questo è un tipo di sistemi termodinamici che non scambiano materia o energia con lo spazio circostante. Un esempio potrebbe essere un thermos contenente tè caldo.
Temperatura termodinamica

Questo concetto indica l'energia cinetica delle particelle che formano i corpi circostanti, che riflette la velocitàmovimento casuale delle particelle. Più è grande, maggiore è la temperatura. Di conseguenza, riducendo l'energia cinetica del sistema, lo raffreddiamo.
Questo concetto indica l'energia cinetica delle particelle che formano i corpi circostanti, che riflette la velocità del movimento caotico delle particelle. Più è grande, maggiore è la temperatura. Di conseguenza, riducendo l'energia cinetica del sistema, lo raffreddiamo.
La temperatura termodinamica è espressa in SI (International System of Units) in Kelvin (in onore dello scienziato britannico William Kelvin, che per primo ha proposto questa scala). Comprendere il primo, il secondo e il terzo principio della termodinamica è impossibile senza una definizione di temperatura.
Una divisione di un grado sulla scala Kelvin corrisponde anche a un grado Celsius. La conversione tra queste unità avviene secondo la formula: TK =TC + 273, 15, dove TK e TC - temperature rispettivamente in kelvin e gradi Celsius.
La particolarità della scala Kelvin è che non ha valori negativi. Zero in esso (TC=-273, 15 oC) corrisponde allo stato in cui il moto termico delle particelle del sistema è completamente assente, sembrano "congelati".
Conservazione dell'energia e 1a legge della termodinamica

Nel 1824, Nicolas Léonard Sadi Carnot, un ingegnere e fisico francese, fece un audace suggerimento che non solo portò allo sviluppo della fisica, ma divenne anche un passo importante nel miglioramento della tecnologia. La suapuò essere formulato come segue: "L'energia non può essere creata o distrutta, può solo essere trasferita da uno stato all' altro."
Infatti, la frase di Sadi Carnot postula la legge di conservazione dell'energia, che stava alla base della 1a legge della termodinamica: "Ogni volta che un sistema riceve energia dall'esterno, la converte in altre forme, la principale di che sono termici e meccanici."
La formula matematica per la prima legge è scritta come segue:
Q=ΔU + LA, qui Q è la quantità di calore trasferita dall'ambiente al sistema, ΔU è la variazione dell'energia interna di questo sistema, A è il lavoro meccanico perfetto.
Processi adiabatici
Un buon esempio è il movimento delle masse d'aria lungo i pendii delle montagne. Tali masse sono enormi (chilometri o più) e l'aria è un eccellente isolante termico. Le proprietà annotate ci consentono di considerare adiabatici tutti i processi con masse d'aria che si verificano in breve tempo. Quando l'aria sale su un pendio di montagna, la sua pressione diminuisce, si espande, cioè esegue lavori meccanici e, di conseguenza, si raffredda. Al contrario, il movimento verso il basso della massa d'aria è accompagnato da un aumento della pressione al suo interno, si comprime e, per questo motivo, diventa molto caldo.
L'applicazione della legge della termodinamica, di cui si è parlato nel paragrafo precedente, è più facilmente dimostrabile usando l'esempio di un processo adiabatico.
Secondo la definizione, di conseguenza non c'è scambio di energia conambiente, ovvero, nell'equazione precedente, Q=0. Questo porta alla seguente espressione: ΔU=-A. Il segno meno qui significa che il sistema esegue un lavoro meccanico riducendo la propria energia interna. Va ricordato che l'energia interna dipende direttamente dalla temperatura del sistema.
Direzione dei processi termici
Questo problema riguarda il 2° principio della termodinamica. Sicuramente tutti hanno notato che se metti a contatto due oggetti con temperature diverse, quello freddo si riscalda sempre, e quello caldo si raffredda. Si noti che il processo inverso può verificarsi nell'ambito della prima legge della termodinamica, ma non è mai implementato nella pratica.
La ragione dell'irreversibilità di questo processo (e di tutti i processi conosciuti nell'Universo) è la transizione del sistema a uno stato più probabile. Nell'esempio considerato con il contatto di due corpi di diverse temperature, lo stato più probabile sarà quello in cui tutte le particelle del sistema avranno la stessa energia cinetica.
La seconda legge della termodinamica può essere formulata come segue: "Il calore non può mai essere trasferito spontaneamente da un corpo freddo a uno caldo." Se introduciamo il concetto di entropia come misura del disordine, allora può essere rappresentato come segue: "Ogni processo termodinamico procede con un aumento di entropia".
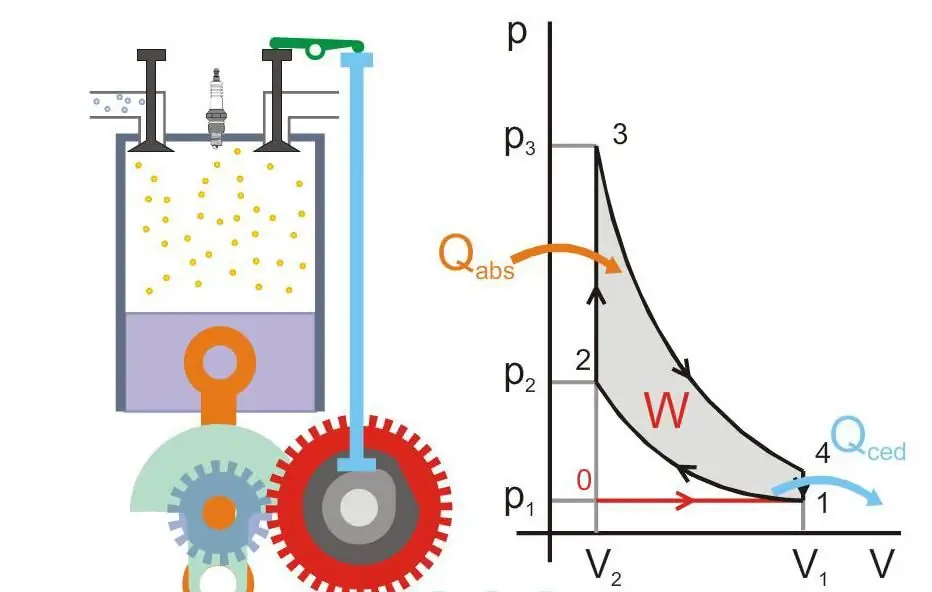
Motore termico

Con questo termine si intende un sistema che, grazie alla fornitura di energia esterna ad esso, può svolgere lavori meccanici. Primole macchine termiche erano macchine a vapore e furono inventate alla fine del 17° secolo.
La seconda legge della termodinamica gioca un ruolo decisivo nel determinarne l'efficacia. Sadi Carnot ha anche stabilito che l'efficienza massima di questo dispositivo è: Efficiency=(T2 - T1)/T2, qui T2 e T1 sono le temperature del riscaldatore e del frigorifero. Il lavoro meccanico può essere eseguito solo quando c'è un flusso di calore da un corpo caldo a uno freddo e questo flusso non può essere convertito al 100% in energia utile.
La figura seguente mostra il principio di funzionamento di un motore termico (Qabs - calore trasferito alla macchina, Qced - dispersione termica, W - lavoro utile, P e V - pressione e volume del gas nel pistone).
Zero assoluto e postulato di Nernst
Infine, passiamo alla considerazione del terzo principio della termodinamica. È anche chiamato postulato di Nernst (il nome del fisico tedesco che lo formulò per primo all'inizio del XX secolo). La legge dice: "Non si può raggiungere lo zero assoluto con un numero finito di processi". Cioè, è impossibile in alcun modo "congelare" completamente le molecole e gli atomi di una sostanza. La ragione di ciò è il costante scambio di calore esistente con l'ambiente.

Un'utile conclusione tratta dalla terza legge della termodinamica è che l'entropia diminuisce man mano che ci si sposta verso lo zero assoluto. Ciò significa che il sistema tende ad organizzarsi. Questo fatto puòutilizzare, ad esempio, per trasferire i paramagneti in uno stato ferromagnetico una volta raffreddati.
È interessante notare che la temperatura più bassa che è stata raggiunta finora è 5·10−10 K (2003, MIT Laboratory, USA).






